מדריך טיפול בסרטן ריאה
מהו סרטן ריאה?
הריאות הם האיבר שבתוכו מתרחש התהליך של העברת החמצן מהאוויר שאנחנו שובים לדם. בריאה השמאלית ישנם שתי אונות ובימנית יש שלוש אונות.
האוויר מגיע לכל חלק בריאות דרך הברונכוס הראשי שמתפצל לשניים – ימין ושמאל ולכל אונה יש דרכי אוויר שמגיעים אליה ומספקים לה חמצן .רוב הגידולים של הריאה, מוצאם מהשכבה שמכסה את דרכי הנשימה (האפיתל).
סרטן ריאות הינו תהליך חלוקה לא תקין ולא מבוקר של תאים כתוצאה משינוי גנטי המתרחש ב-DNA של התא.
במאמר זה נלמד על:
- גורמי המחלה
- תסמינים
- סוגי סרטן הריאה
- כלל הבדיקות
- שלבי המחלה
- טיפול
- תופעות הלוואי של טיפולי הכימותרפיה
- איך מתבצע טיפול בקרינה?
- איך להתנהל לאחר הטיפול
ישנם שני סוגים עיקריים של סרטן ריאה:
- סרטן ריאה מסוג תאים קטנים או SMALL CELL LUNG CANCER המהווה כ-15% מגידולי הריאה והוא קשור באופן בלעדי בעישון.
- סרטן ריאה מסוג תאים לא קטנים: NON SMALL CELL LUNG CANCER המהווה כ-85% מגידולי הריאה.
בתוך סוג זה של מחלה ישנם תתי סוגים אחרים כגון:
- ADENOCARCINOMA – הסוג השכיח -70 אחוזים
- SQUAMOUS CELL CARCINOMA -15 אחוזים
- סוגים אחרים פחות שכיחים כגון: קרצינואיד, גידולים נוירואנדוקרינים , סרקומה ו-LARGE CELL CARCINOMA.
גידולים שפירים
בנוסף לגידולים הממאירים ישנם גם ממצאים שפירים שיכולים לבלבל עם סרטן כגון : המרטומה, המנגיומה, סרקואידוזיס וכדומה.
הקרצינואיד – גידול מיוחד שיכול להיות שפיר בחלק מהמקרים וממאיר בחלק אחר מהמקרים וזה תלוי בקצב החלוקה של התא.
מהם הגורמים לסרטן הריאה?
עישון הוא הגורם העיקרי לסרטן הריאות והוא אחראי על כ-80-85% מסה"כ מקרי סרטן הריאות ישנם סוגים של סרטן ריאות שקשורים כמעט באופן בלעדי לעישון כגון : SMALL CELL LUNG CANCER ו- SQUAMOUS CELL CARCINOMA.
סיגריה מכילה למעלה מ-300 סוגים שונים של רעלנים. הניקוטין הוא הרעלן המפורסם ביותר, אך לא היחידי. לרעלנים האלו יש את היכולת לגרום לשינויים גנטיים ברמה של ה-DNA ובכך להאיץ את התהליך הסרטני.
הרעלנים השונים תלויים בסוג חומר העישון ובתהליך של העישון עצמו (שריפה או אידוי כמו בנרגילה) והשימוש בפילטרים ולכן לא רק עישון של סיגריות טבק גורם לסרטן אלא גם עישון: מקטרת, סיגרים, נרגילה ואף עישון מריחואנה.
יודגש כי במקרה של מריחואנה הכוונה היא לחשיפה מתמשכת וכרונית לעישון ולא מדובר בעישון לתקופה קצרה – למשל תקופה של מספר חודשים שחולה אונקולוגי משתמש בקנביס רפואי לצורך איזון.
חלק נכבד מגידולי הריאה נגרם גם כתוצאה מעישון פסיבי. עישון פסיבי הוא מצב שהחולה נחשף באופן מתמשך לנזקי העישון על ידי בן משפחה בביתו או במקום העבודה על בסיס קבוע.
הסיכון והנזק כתוצאה מעישון מחושב לפי מספר קופסאות לשנת עישון, אף על פי כן גם עישון של מעל 10 קופסאות עבור שנת עישון נחשב לגורם סיכון או פחות מזה יכול להזיק.
גורמים אחרים ל-20 אחוזים ממקרים של סרטן ריאה הם:
- גיל: סרטן ריאה הוא מחלה ששכיחה יותר מעל גיל 65.
- גורמים גנטיים: מעט מאד מקרים.
- גורמים סביבתיים כגון זיהום אוויר וחשיפה מתמשכת לגז הראדון, חשיפה לחומרים כימיים או קרינתיים.
מהם התסמינים של סרטן ריאה?
התסמינים תלויים בשלב המחלה ובמחלות הרקע של החולה.
מאחר ורוב החולים הינם מעשנים "כבדים" אזי ישנו סיכוי גבוה גם לקיומה של מחלת הריאות הכרונית COPD ולכן התסמינים יכולים להיות מבלבלים:
- שיעול יבש או ליחתי עם או בלי דם.
- קוצר נשימה.
- דלקות ריאה חוזרות.
- כאבים בחזה.
- בשלבים יותר מתקדמים : כאבים בבטן או בעצמות במיוחד עצמות האגן ועמ"ש.
- ירידה במשקל ובתאבון.
- חום.
- במידה ויש מעורבות של חוט השדרה יכול להיות גם שיתוק של הגפיים.
- גרורות במח- כאבי ראש.
- בחילות.
- הקאות.
- פרכוסים.
אלו סוגי סרטן ריאה קיימים?
סרטן ריאה מסוג תאים קטנים – SCLC – Small Cell Lung Cancer – 15%:
סוג זה של מחלה קשור באופן בלעדי לעישון. רוב החולים מתגלים בשלב של מחלה מפושטת.
הטיפול הוא כימותרפיה עם שיעורי תגובה גבוהים אך משך התגובה הוא קצר מאד ולכן רוב החולים נפטרים תוך פחות משנה, במעט החולים שמאובחנים בשלב התחלתי- לא מקובל לעשות ניתוח ומסתפקים בשילוב של טיפול כימותרפי עם קרינה.
בשנה האחרונה התפרסמו שתי עבודות מחקר שבדקו את המקום של תוספת של טיפול אימונותרפיה כגון IMFINZI ו-TECENTRIQ למשלב הכימותרפי הסטנדרטי ומצאו שהתוספת של התרופות הללו שיפרה את תוחלת החיים בעוד מספר חודשים ולכן השילוב הזה נחשב לטיפול הסטנדרטי על פי ההנחיות הבינלאומיות והוא יוגש לסל שנה הבאה.
סרטן ריאה מסוג תאים שאינם קטנים- NSCLC – Non-Small Cell Lung Cancer 80-85%:
בקבוצה זו יש תתי סוגים שונים:
- אדנוקרצינומה – ADENOCARCINOMA70%
- קרצינומת תאים קשקשיים – SQUAMOUS CELL CARCINOMA – SCC15%
- אחרים: 15% שבתוכם:
א. קרצינומת תאים גדולים- LARGE CELL CARCINOMA
ב. גידול נוירואנדוקריני דרגת התמינות נמוכה= קרצינואיד טיפוסי
ג. גידול נוירואנדוקריני דרגת התמינות בינונית/גבוהה= קרצינואיד לא טיפוסי
ד. סרקומה
ה. סוגים נדירים ביותר
מזותליומה (Mesothelioma):
זהו אינו גידול ריאתי, אלא גידול של מעטפת הריאה ( הפלוירה) והוא קשור כמעט באופן בלעדי לחשיפה לאסבסט. זמן הדגירה הממוצע מאז החשיפה עד להופעת הגידול כ-20 שנה.
המחלה לרוב, מופיעה באופן מתקדם עם מעורבות של קרומי הריאה בשילוב בלוטות הלימפה ואף פולשת לרקמת הריאה עצמה.
לא מקובל לבצע ניתוח לגידול זה בגלל היקף המחלה והיקף הניתוח שמחייב הוצאה של קרומי הריאות וחלק מהריאה הנגועה ובדרך כלל לא ניתן להשיג שוליים נקיים.
הטיפול המקובל הוא כימותרפיה – שילוב של מלחי פלטין עם אלימטא. ישנם דיווחים לאחרונה על התועלת של אימונותרפיה במחלה זו במיוחד שילוב של 2 תרופות אימוניות, אך הנתונים עדיין ראשוניים.
סוגים נוספים ונדירים של סרטן ריאה:
- Adenosquamous carcinoma of the lung.
- Large cell neuroendocrine carcinoma.
- Salivary gland-type lung carcinoma.
- Sarcomatoid carcinoma of the lung.
- Granular cell lung tumours.
ביופסיה תחת CT:
לאחר הסתכלות על הצילומים, מתאים לגידולים ברקמת הריאות שיש להם גישה תחת הנחית CT מבוצעת ללא הרדמה בזמן שהחולה שוכב בתנוחה שתתאים להכוונת המחט תחת CT. לא מתאים לקשריות מאחורי צלעות למשל.
ביופסיה פתוחה : מידיאסטינוסקופיה או טורקוסקופיה – זהו ניתוח לכל דבר שמטרתו לקיחת ביופסיה טובה במידה ואין אפשרות בעזרת השיטות האחרות.
סריקת CT
ברונכוסקופיה (Bronchoscopy): שיטת אבחון המבוצעת תחת טשטוש על ידי החדרה של צינור עם מצלמה דרך דרכי הנשימה המרכזיים ובעזרתו ניתן ליטול ביופסיה ממצא שנגיש בזמן הדביקה על פי רוב ניתן לעשות בדיקה שנקראתFNA , זוהי ביופסיה קטנה עם תאים בלבד ולא ממש רקמה וזה אחד החסרונות של הבדיקה הזו.
כפי שידוע ישנה חשיבות רבה לקחת ביופסיה רקמתית של ממש ולא רק תאים בודדים ציטולוגיה מאחר ויש צורך בכמות מירבית של רקמה ע"מ לבצע פרופיל גנומי מולקולרי מקיף -COMPREHENSIVE MOLECULAR PROFILING.
בדיקות נוספות לצורך בדיקה האם המחלה התפשטה לבלוטות האיזוריות:
- אולטרסאונד אנדוסקופי (EUS):
זוהי בדיקה המתבצעת דרך גסטרוסקופ, צינור ארוך, צר וגמיש שעוביו כאצבע, הצינור עשוי סיבים אופטיים ועטוף בחומר פלסטי. באמצעות המכשיר ניתן לצפות במערכת העיכול העליונה ולבצע פעולות שונות.
- מדיאסטינוסקופיה (Mediastinoscopy):
זוהי פעולה כירורגית-ניתוחית אשר מצליחה לבחון איברים ורקמות במייצר ('מדיאסטנום'), זהו האזור שבין שתי הריאות, המכיל את הלב, כלי הדם הגדולים, קנה הנשימה, הוושט ובלוטות הלימפה.
- מדיאסטינוסקופיה:
יכולה לעזור באבחון גידולים במייצר, כגון: לימפומה. אצל חולים עם גידול בריאה, ניתן להיעזר במדיאסטינוסקופיה על מנת לאבחן תאים ממאירים בבלוטות הלימפה במייצר.
- טורקוסקופיה (Thoracoscopy):
הליך ניתוחי זעיר פולשני לאבחון וטיפול במחלות בבית החזה באמצעות שימוש במצלמות זעירות ומכשירי עבודה המוחדרים לחזה דרך חורים קטנים. באמצעות הטורקוסקופיה ניתן לקחת דגימות מאזורים שונים, במקום לבצע חתך ניתוחי גדול. הטיפול באמצעות טורקוסקופיה משמש לאבחון מחלות במעטפת הריאה (פלאורה), אבחון מחלות במייצר (האזור שבין שתי הריאות), כריתת גידולים קטנים מהריאה והמייצר במידה ומתאפשר, לא מתאים לכל מקרה.
- סריקת PET-CT (פליטת פוזיטרונים טומוגרפית):
זוהי בדיקת הבחירה לצורכי STAGING- דירוג הסרטן וקביעת שלב ההתפשטות שלו. בדיקה זו היא שילוב של CT ביחד עם בדיקה מטבולית שבמהלכה חומר רדיואקטיבי ( על פי רוב גלוקוז מסומן ) שנקלט בתאי הגידול. הרגישות והספציפיות של הבדיקה היא מעל ל-90 אחוזים. ישנם מצבים של קליטת יתר שהם לא סרטניים: דלקת, מחלת ריאה שפירה כגון סרקואידוזיס.
- סריקת MRI (הדמיית תהודה מגנטית):
מומלץ לבצע MRI מח בזמן גילוי המחלה. אין מקום בדרך כלל לבצע MRI של הריאות–הבדיקה לא ברורה ומבלבלת.
- בדיקת תפקודי ריאות – SPIROMETRY:
זוהי בדיקה כמותית שמבוצעת לצורך הערכה של תפקודי הריאה . בדרך כלל לפני התערבות ניתוחית או טיפול קרינתי .הבדיקה אורכת כ-15 דקות ומבוצעת ללא הרדמה או טשטוש היות ואינה כואבת. הבדיקה מבוצעת על ידי נשיפה מאומצת לתוך מכשיר ספירומטר לאחר מתן מרחיבי סימפונות.
המדדים החשובים לבדיקת תפקודי ריאות:
FVC- כמות האוויר המקסימלי שננשף לאחר שאיפה מקסימלית.
FEV1- כמות האוויר המקסימלי הננשף בשנייה ראשונה
איך נקבע שלב המחלה בסרטן ריאה?
הדירוג נעשה בדרך כלל לאחר וידוי של האבחנה על ידי PET CT ו-MRI של המוח. הדירוג נעשה ע"י שיטת ה- TNM וגירסה האחרונה היא המהדורה מספר 8. בדרך כלל ישנה התייחסות של גודל הגידול –T, מעורבות של בלוטת לימפה –N והימצאות גרורות M.
שלב 1-2: גידולים עד 7 ס"מ ללא מעורבות של בלוטות או גידולים עד 5 ס"מ עם או בלי מעורבות שלבלוטה אונתית (N1)- וללא פיזור מרוחק.
שלב 3: הוא שלב ביניים של מחלה מתקדמת מקומית וללא פיזור גרורתי מרוחק. בדרך כלל מדובר בגידול עם מעורבות של בלוטות לימפה במיצר או גידול מעל ל-7 ס"מ עם מעורבות של איברים סמוכים כגון לב וכלי דם גדולים.
שלב 3A: בלוטה באותו צד של המיצר (N2) או גידול מעל 7 ס"מ עם בלוטה N1.
שלב 3B: בלוטה ב\צד השני של המיצר N3.
שלב 4: פיזור גרורתי מרוחק כגון מח, עצמות , כבד וכו.
מהם הטיפולים לסרטן ריאה לפי השלבים?
הטיפול הראשוני לשלבים 1/2: בדרך כלל ניתוח בו מבוצעת הסרה של האונה המכילה את הגידול הראשוני –LOBECTOMY עם דגימה של בלוטות הלמפה מהמיצר. בחלק מהמקרים יש צורך בכריתת ריאה שלמה – פנוימוניקטומי במידה והגידול מערב יותר מאונה אחת או שמערב את שער הריאה.
בסרטון ד"ר מילטון סאוטה מסביר על ניתוח זעיר פולשניים בסרטן הריאה
מהו הטיפול הכימי (כימותרפיה) לסרטן ריאה?
ישנם 3 מצבים שונים למתן טיפול כימי:
- טיפול כימי משלים: טיפול שניתן לאחר הסרת הגידול בצורה ניתוחית לכל הגידולים מעל 4 ס"מ או שמערבים בלוטות לימפה, הטיפול בדרך כלל ניתן במשלב של מלחי פלטין ביחד עם נבלבין למשך 4 חודשים. מטרת הטיפול המשלים הוא טיפול מונע והוכח שמשפר את תוחלת החיים בין 5-15 אחוזים.
- טיפול טרום ניתוחי- טיפול שניתן לפני ניתוח במטרה להקטין את הגידול או להפוך מחלה לא נתיחה לנתיחה.
- טיפול דיפיניטיבי-ניתן ביחד עם טיפול קרינתי לצורך ריגוש יתר של התאים הסרטניים לטיפול הקרינתי. בדרך כלל ניתן בשלב 3 ומשלב לרוב מלחי פלטין עם טקסול במינון שבועי מותאם לקרינה.
- טיפול במחלה גרורתית: בשלב 4 ברגע שאין אפשרות לניתוח. נותנים 4 עד 6 מחזורי טיפול ע"ב של מלחי פלטין עם אלימטא או טקסול או גמזר ביחד עם התרופה קיטרודה, טיפול אימונותרפי מהקבוצה של מעכבי PD1. השילוב הזה ניתן לכל החולים במצב טוב בשלב 4 עם ביטוי חלש של חלבון PDL1 ( מתחת ל-50%). חולים עם חלבון שהוא מעל ל-50% יוכלו לקבל קיטרודה כתרופה בודדת ללא צורך בטיפול כימי.
יש להתייחס גם לנקודות הבאות:
כימו-רדיותרפיה (Chemoradiation) – שילוב של קרינה ביחד עם כימותרפיה ניתן במחלה מתקדמת מקומית לא נתיחה – שלב 3. מטרת הטיפול היא שליטה מקסימלית של המחלה בלי ניתוח עם סיכויי ריפוי עד כ20 אחוזים. לאחרונה התפרסמו מחקרים אשר הראו כי חולים שקיבלו את הטיפול המשולב והמשיכו לאחר מכן עם טיפול אימונותראפי בשם אימפינזי השיגו שיפור ניכר בזמן עד התקדמות המחלה וכעת זה נחשב כטיפול הסטנדרטי בשלב זה.
טיפול לסרטן ריאות מסוג תאים קטנים (SCLC)
טיפול לסרטן ריאות מסוג תאים לא קטנים (NSCLC)
מהן התרופות אימונותרפיות :
מעכבי PD1:
- PEMBROLEZUMAB KYTRUDA
- NIVOLUMAB OPDIVO
מעכבי PDL1:
- ATEZULEZUMAB TECENTRIQ
- DURVALUMAB IMFINZI
מהן תופעות הלוואי של טיפול אימונותרפי?
בדרך כלל התרופות האלו קלות ביותר בגלל מנגנון הפעולה שלהם. רוב החולים יסבלו מדרגה קלה ביותר של: חולשה ותופעות עוריות קלות.
כ-10 אחוזים מהחולים יסבלו מתופעות לוואי אוטו-אימוניות שקשורות לשפעול יתר של המערכת החיסונית כגון:
- שינויים בבלוטת התריס (היפו או היפר).
- קוליטיס ( מתבטא בשלשול).
- פנוימוניטיס (כ-2 אחוזים דרגה קשה ואף קטלנית ולכן צריך לעקוב לאחר התפתחות של קוצר נשימה בזמן טיפולים אלו ולשלב פנוימוניטיס).
עקרונית תרופות אלו עשויות לפגוע בכל איבר ואיבר בגוף אך הסיכויים הם פחות מ-1% לפגיעה קשה ובלתי הפיכה.
איך מתבצעת קרינה (רדיותרפיה) לחולי סרטן ריאה?
טיפול בקרינה לסרטן מסוג תאים לא קטנים (NSCLC): הטיפול הזה ניתן לרב בשלב 3 ביחד עם טיפול כימי או כטיפול פליאטיבי במחלה מפושטת להקלת תסמינים, למשל גוש שחוסם דרכי נשימה מרכזיים או לגרורה שפרצה לתעלת חוט השדרה.
טיפול בקרינה לסרטן מסוג תאים קטנים (SCLC)
מהי קרינה חיצונית?
קרינה שניתנת על ידי מאיץ לאיזור נרחב בגוף, כגון קרינה של כל המיצר ושער הריאה או קרינה של גוש גידולי. ניתנת במנות קטנות למשך יותר זמן, בין 10-30 טיפולים לעומת קרינה סטריוטקטית שהיא קרינה ממוקדת לגידול קטן עד 3 ס"מ כך שאפשר לתת מנה גדולה יותר פר טיפול ולסיים את הטיפול מהר יותר.
מהי קרינה סטריאוטקטית?
זוהי שיטה המטפלת בגידולים (ראשונים או משניים).
מהי קרינה פנימית (ברכיתרפיה)?
במידה ויש גידול חוסם בתוך הברונכוס ניתן להגיע למקום בעזרת ברונכוסקופ ולתת קרינה פנימית ממוקמת. בד"כ 2-3 טיפולים לצורכי פליאציה בלבד.
מהי קרינה מניעתית למוח בגידול מסוג SCLC?
קרינה שניתנת לכל חולי SCLC שסיימו טיפול כימי/קרינתי כטיפול מונע להתפתחות גרורות מוחיות . טיפול מאד שנוי במחלוקת ולא כל הרופאים ממליצים עליו כרוטינה.
מהי קרינה פליאטיבית?
קרינה פליאטיבית היא הקרינה שניתנת לאיזור מסוים בגידול על מנת להקל על הסימפטומים ושיפור איכות חיים כגון; קרינה של גוש ריאתי שחוסם ברונכוס- להקל על הנשימה או קרינה של גרורה בעמ"ש שפרצה לתעלת חוט הדרה ע"מ למנוע שיתוק או קרינה לגרורות מוחיות מרובות.
האם ישנן תופעות לוואי ארוכות טווח מטיפול קרינה בסרטן ריאה?
חולים בשלב 3 המקבלים טיפול כימו-קרינתי יכולים לסבול מתופעות לוואי אקוטיות קשות יותר כגון; חולשה, עייפות, קושי בבליעה ואף דלקת ריאות לא חיידקית– פנוימוניטיס או במקרים נדירים פיסטולות.
תופעות לוואי לטווח ארוך יכולות להיות היצרות בושט, תופעות לוואי קרדיאליות אך התופעות הללו נדירות.
מהו טיפול מכוונן ממוקד מטרה Targeted Therapy לסרטן ריאה?
כיום אפשר לבצע בדיקות מולקולריות מקיפות-COMPREHENSIVE MOLECULAR PROFILING על רקמת הגידול ובחלק מהמקרים גם מהדם (במידה ויש שפיכה של DNA גידולי לדם), לחפש מוטציות שהם שינויים גנטיים בגידול שגרמו לתהליך הסרטני ולהתאים טיפול תרופתי מכוון כנגד שינויים אלו.
תרופות אלו נקראות תרופות ביולוגיות מכוונות מטרה מאחר והן פועלות על קולטן ספציפי בתא ולכן הן יותר ספציפיות לתאי הגידול ויש להם פחות השפעה על שאר התאים הבריאים בגוף וזה גורם לכך שתופעות הלוואי של תרופות אלו היא קלה יחסית ומתבטאת בדרך כלל בחולשה קלה ועייפות, פריחה עורית ושלשול. בד"כ אין לתרופות אלו השפעה על ספירות הדם.
תרופות אלו ניתנות דרך הפה ולכן מהר מאד החולים שמקבלים אותם יכולים לחזור למעגל החיים הטבעיים.
מהן הבדיקות הגנטיות למוטציות של סרטן ריאה:
ישנם הרבה בדיקות מאושרות FDA כיום בשוק וניתן לבדוק בחלק מהבדיקות היום עד כ-500 מוטציות שונות, אך צריך לזכור שכיום יש לנו רק עד כ-10 מוטציות שהצלחנו להתאים להן טיפול מכוון.
הסיכוי למצוא את מוטציות הללו הוא גבוה מאד בחולים שהם: נשים, לא מעשנים, צעירים ועם אדינוקרצינומה. בדיקות הללו מבוצעות כיום כחלק מהעיבוד של כל חולה עם NSCLC כבר בתחילת הדרך .
כיום ניתן גם לבדוק מוטציות של עמידות לתרופות הביולוגיות כך למשל ניתן לחפש מוטציה שנקראת T790M בדם של מטופל אשר קיבל תרופה כמו אריסא, טרסיבא או ג'יוטריף ומחלתו התקדמה . הסיכוי למוטציה כזאת הוא 60% וברגע שהיא נמצאת ניתן שוב להתאים טיפול.
המוטציות הקיימות כיום:
- EGFR 15%
- ALK 4%
- ROS1 1%
- BRAF 1%
- MET1%
- RET1%
- HER II1%
- Ntrk 0.1%
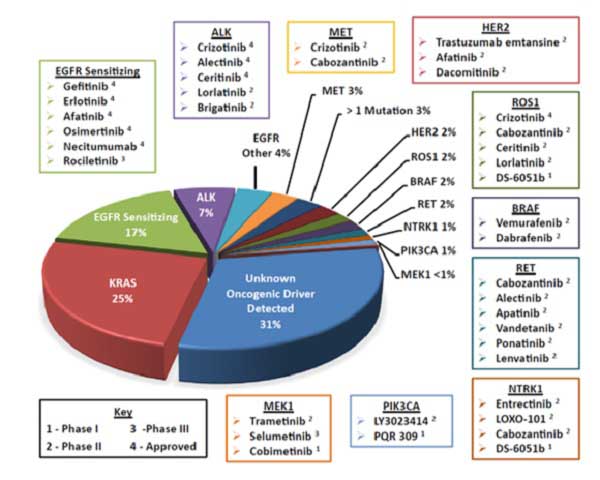
מהן התרופות המכווננות נגד קולטני EGFR?
- IRESSA GEFITINIB
- TARCEVA ERLOTINIB
- GIOTREF AFATINIB
- TAGRESSO OSIMERTINIB
מהן התרופות מכווננות נגד פגם בחלבון ALK?
- קריזוטיניב – Crizotinib (קסלקורי® – ®Xalkori).
- אלקטיניב – ALECENZA.
- בריגטיניב ALUNBERG.
- לורלטיניב-LORVIQUA.
- סיריטיניב- לא בשימוש בארץ .
מהי אימונותרפיה? תרופות מכווננות חוסמי קולטן 1-PD-1/PDL:
ניבולומאב – Nivolumab (אופדיבו® – ®Opdivo).
פמברוליזומאב – Pembrolizumab (קיטרודה® – ®keytruda).
מהם נוגדנים חד-שבטיים?
בווציזומאב – bevacizumab (אווסטין® – ®Avastin): תרופה שניתנת כתוספת לטיפול הכימי הסטנדרטי כמעט ולא ניתנת כיום באופן שגרתי . ניתן לשקול תרופה זו כתוספת לעוד תרופות לחולים עם גרורות מוחיות. התרופה היא ביולוגית ומעכבת קולטן של צמיחה של כלי הדם VEGF.
מהם טיפולים נוספים לסרטן ריאה:
מספר תרופות שנבדקו ונמצאו שיש להם מקום אך לא קיימים בסל והשימוש בהם באמת מוגבל ביותר בגלל שיעילותם היא גבולית:
- RAMUCERUMAB.
- NICITOMUMAB.
- NUNTADENIB.
כמובן, מחקרים קליניים שמתעדכנים כל הזמן.
כיצד עלי לנהוג בסיום הטיפול בתקופת המעקב?
הטיפול המומלץ בחולים שהבריאו מהמחלה הוא בדיקת הדמיה, לרוב, כל 4-6 חודשים בשנתיים הראשונות ולאחר מכן פעם בחצי שנה עד 5 שנים.
כמובן מומלץ לאמץ אורח חיים בריא שכולל פעילות גופנית המשלבת הליכה, שיקום תפקודי ריאה וכמובן הפסקת עישון.
שאלות ותשובות בנושא
איך ומתי מאבחנים סרטן ריאה?
לפי המיקום של הממצא הנגיש ביותר יוחלט על סוג הבירור לצורך נטילת ביופסיה. גידולים מרכזיים שמערבים את שער הריאה על ידי גוש מתמשך או מעורבות של בלוטת לימפה או ממצא בתוך הברונכוסים הראשיים יתאימו לברונכוסוקופיה.
דרך נוספת לנטילת ביופסיה היא על ידי מחט מונחת אולטראוסאונד או מה שנקרא EBUS- ENDOBRONCHIAL US , בדרך כלל מתאים לבלוטות נגועות מתחת לקרינה ( ההתפצלות הראשית של הברונכוס).
מהן תופעות הלוואי של הטיפול הכימותרפי?
- נשירת שיער
- בעיות פוריות
- בחילות והקאות
- שלשולים
- פצעים בעור
- ירידה בספירות הדם
- השפעה על התפקוד הכלייתי ושל הכבד
- נוירופתיה פרפרית, הפרעות קוגניטיביות
מהן תופעות הלוואי של טיפול בקרינה?
תגובות
תמונות לפני ואחרי של רופאים מהאתר
כתבות בנושא
טיפול בסרטן ריאות: פריצת הדרך
ד"ר עבד אגבאריההטיפול האימונתרפי בסרטן הריאות משפר כיום את שרידות החולים. הטיפול, שנכלל בסל התרופות, יכול להינתן כטיפול בלעדי ללא צורך בניתוח או בכל טיפול אחר, או בליווי טיפול כימותרפי גורמים | התאמה | אבחנה | טיפול |...
סרטן ריאה חיובי למוטציית ALK: הטיפול החדש
ד"ר מיה גוטפרידסרטן הריאה הינו הסרטן השלישי בשכיחותו בישראל, ונחשב לגורם התמותה הראשון ממחלת הסרטן. בתוך קטגוריית סרטן הריאות, קיים סרטן אלים ואגרסיבי במיוחד הנקרא סרטן ריאה חיובי למוטציית ALK. כיום זוכה סוג סרטן זה לטיפול באמצעות...
סרטן ריאה: האבחון והטיפולים החדשים
ד"ר מיה גוטפריד2,200 ישראלים מאובחנים מדי שנה עם סרטן ריאה אשר מהווה גורם התמותה מספר 1 מבין מחלות הסרטן וזאת בעיקר לאור הגילוי המאוחר של המחלה. לאחרונה, חלה מהפיכה בטיפול בסרטן ריאה באמצעות אימונותרפיה , אשר זוכה...